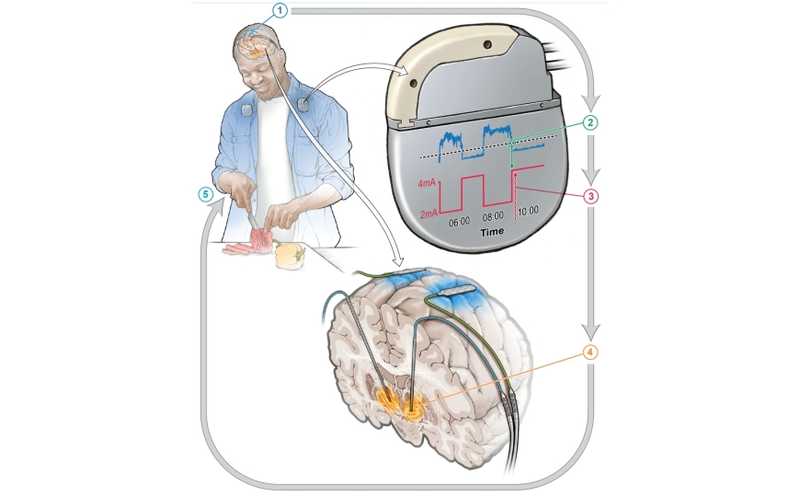
Стимуляция глубинных структур мозга с помощью имплантированных электродов, управляемых собственной мозговой активностью пациента, более эффективно облегчает симптомы болезни Паркинсона, чем стимуляция с постоянной амплитудой. В пилотном исследовании участвовало четыре человека, и у всех отмечено повышение качества жизни на фоне персонализированной нейростимуляции.
Phillp Starr Lab | Пресс-релиз
Болезнь Паркинсона (БП) — широко распространенное нейродегенеративное заболевание, поражающее около одного процента людей в возрасте от 60 лет в странах с высоким уровнем дохода. Пациентам обычно назначают леводопу — препарат, который восполняет дефицит дофамина в мозге. Также применяется глубокая стимуляция мозга (deep brain stimulation, DBS) — введение электродов в область субталамического ядра (STN), ответственного за контроль движений. Небольшое исследование, финансируемое Национальными институтами здравоохранения США (NIH), показало, что если стимулирующий сигнал имеет не постоянную амплитуду, а регулируется активностью мозга пациента, это более эффективно облегчает симптомы. Такой тип лечения назвали адаптивной глубокой стимуляцией мозга (adaptive deep brain stimulation, aDBS).
При обычной DBS уровень стимуляции постоянен, и это может привести к нежелательным побочным эффектам. Например, количество леводопы в мозге колеблется, достигая пика вскоре после приема препарата и постепенно снижаясь по мере того, как он метаболизируется в организме. Соответственно, изменяются активность нейронов и выраженность симптомов. При адаптивной стимуляции сигнал корректируют в реальном времени с помощью данных об активности мозга, по принципу обратной связи.
Исследователи под руководством Филиппа Старра из Калифорнийского университета в Сан-Франциско много лет работают над этим проектом. Систему для адаптивной стимуляции мозга, основанную на обратной связи, они описали еще в 2018 году, а в 2021 году представили способ регистрации мозговой активности у людей, занятых повседневными делами. Эти разработки были положены в основу управления системой aDBS.
В пилотном исследовании участвовало четверо мужчин в возрасте от 47 до 68 лет, находившихся на обычной немодулированной DBS. Каждому пациенту установили двусторонние электроды в STN и субдуральные (лежащие на поверхности мозга) электроды над сенсомоторной корой (1). Пациенты определили, какие симптомы для них наиболее неприятны и хуже поддаются лечению. Зачастую это были непроизвольные движения либо трудности с началом движения. Затем им предлагали пройти aDBS наряду с обычной DBS.
Нейронная активность фиксировалась как глубинными, так и субдуральными электродами (2). Когда она превышала определенный порог или становилась слишком низкой, соответственно уменьшалась или увеличивалась амплитуда стимулирующего сигнала (3). Это улучшало моторную симптоматику, например, исчезало замедление движений (4, 5). Таким образом, aDBS может сгладить колебания симптоматики, в том числе адаптируясь к колебаниям уровня леводопы. Это делает ее привлекательным вариантом для пациентов, которым необходимы высокие дозы препарата.
Воздействие DBS изменило мозговую активность настолько, что сигнал, который, как изначально предполагали авторы, должен был управлять системой aDBS, не обнаруживался. Для идентификации другого сигнала потребовались специальные вычислительные подходы. Оптимальными маркерами высоких по сравнению с низкими дофаминергическими состояниями и связанных с ними особенностей моторики у всех четырех пациентов были гамма-колебания, вызванные стимуляцией, в субталамическом ядре или двигательной коре.
После обучения алгоритма aDBS в течение нескольких месяцев участников отпускали домой и сравнивали обычную стимуляцию и aDBS, которые чередовали каждые два-семь дней.
Наиболее беспокоящие симптомы на фоне aDBS проявлялись на 50% слабее по сравнению с обычной DBS. Сами участники не знали, когда менялся тип стимуляции, но трое из четырех верно угадывали, когда были на aDBS, по заметному улучшению состояния.
Серьезное неблагоприятное событие отмечено у одного пациента: послеоперационная односторонняя инфекция вживленных электродов в одном полушарии. Замененное устройство функционировало нормально.
В настоящее время первоначальная настройка прибора крайне сложна и требует высокой квалификации врачей. Исследователи предполагают, что настройку удастся в значительной мере автоматизировать: это облегчило бы применение терапии в клинических условиях.
Ранее исследователи из Калифорнийского университета в Сан-Франциско опубликовали статью о том, что адаптивная глубокая стимуляция мозга может облегчить бессонницу при болезни Паркинсона.
Прасинезумаб улучшает моторные симптомы при быстрой прогрессии болезни Паркинсона
Источник
Oehrn, C.R., et al. Chronic adaptive deep brain stimulation versus conventional stimulation in Parkinson’s disease: a blinded randomized feasibility trial // Nature Medicine (2024). DOI: 10.1038/s41591-024-03196-z